2025年早稲田中学の問題です。
塩酸に金属を加えたときの変化について、以下の問いに答えなさい。
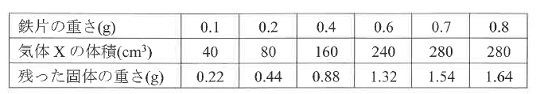
ある濃さの塩酸Aに鉄片を入れると、鉄片は気体Ⅹを発生しながら溶けます。この反応における「鉄片の重さ」、発生する「気体Ⅹの体積」、気体Xの発生が終わった後の液を蒸発させて「残った固体の重さ」の関係を調べました。このとき行った実験の操作は次の通りです。
操作① 塩酸Aを40cm3入れたある容器に、重さをはかった鉄片を入れた。
操作② 発生した気体Ⅹを集め、その体積を測定した。
操作③ 気体Ⅹの発生がすべて終わった後、容器の中にあるものすべてを別の容器に移した。
操作④ その容器を弱火で熱し、液をすべて蒸発させて残った固体の重さを測定した。
操作⑤ 様々な重さの鉄片で操作①~④を繰り返した。
測定結果を次のように表にまとめました。
問1 粉状のものをはかるときの一般的な電子てんぴんの使い方として.最もふさわしい説明文を選び、記号で答えよ。
ア 電子てんぴんのゼロ点調節ボタンを押し、表示を0gにしてから、電子てんぴんの上に紙をのせ、はかりたいものを少しずつのせる。
イ 電子てんぴんのゼロ点調節ボタンを押し、表示を0gにしてから、はかりたいものを少しずつのせる。
ウ 電子てんぴんの上に紙をのせ、はかりたいものを少しずつのせる。
エ 電子てんぴんの上に紙をのせ、重さを記録してから、はかりたいものを少しずつのせる。
オ 電子てんぴんの上に紙をのせ、ゼロ点調節ボタンを押し、表示を0gにしてから、はかりたいものを少しずつのせる。
問2 気体Ⅹと同じ気体を発生する実験操作はどれか。最もふさわしいものを選び、記号で答えよ。
ア 塩酸に銅片を入れる。
イ 塩酸に石灰石を入れる。
ウ お酢に鉄片を入れる。
エ お酢に石灰石を入れる。
オ 水酸化ナトリウム水溶液にアルミニウム片を入れる。
力 水酸化ナトリウム水溶液に鉄片を入れる。
問3 60cm3の塩酸Aに、鉄片は最大で何gまで溶けるか。また、そのとき発生した気体Xの体積は、何cm3か。
問4 60cm3の塩酸Aに、鉄片2.0gを入れたあと、操作③と④を行った。容器に残った固体の重さは、何gか。
問5 容器に塩酸Aの2倍の濃さの塩酸を(Y)cm3入れ、そこに鉄片1.0gを入れた。このとき、鉄片は溶け残り、気体Ⅹは210cm3発生した。Yの値を答えよ。
【解説と解答】
問1 電子てんびんの場合、紙をのせたあと、いったん表示を0にして、それから少しずつはかりたいものを載せます。
(答え)オ
問2 鉄片に塩酸をかけると、水素が発生します。水素が発生する反応はオです。
(答え)オ
問3 鉄片に塩酸をかけると、水素が発生して、塩化鉄ができます。表を見ると、鉄片の重さが0.7gまでは比例していますが、0.8gでは期待の発生が止まっていて、残った固体が0.1g増えているので、この0.1gは鉄です。したがってこの反応では鉄0.7gと塩酸40cm3が過不足なく反応し、気体が280cm3、塩化鉄が1.54gできます。塩酸60cm3にすると、1.5倍ですから、鉄は0.7×1.5=1.05g。気体は280×1.5=420cm3。
(答え)鉄片1.05 気体X 420
問4 塩酸60cm3に反応する鉄は1.05gですから、1.05×2.2=2.31gの塩化鉄と、2-1.05=0.95gの鉄が残るので、合計2.31+0.95=3.26gの固体が残ります。
(答え)3.26
問5鉄1.0gが完全に反応すると、280×10/7=400cm3の気体が発生しますが、210cm3だけなので、鉄は1×210/400=0.525gが反応しました。
鉄0.525gに反応する塩酸Aは40×0.525/0.7=30cm3ですから、2倍の濃さであれば15cm3になります。
(答え)15
